Cell :中国学者一作!添加一个关键“零件”,打造“超级CAR-T细胞”,有望攻克实体瘤
来源:iNature 2025-12-09 09:58
该研究证明利用T细胞前发育的独特特征提供了一种增强CAR-T细胞的替代机制,这依赖于Y-Box结合蛋白1 (YBX1)调节的mRNA翻译。
2025 年 12 月 2 日,哥伦比亚大学Michel Sadelain 团队(Shi Yuzhe 为论文第一作者)在 Cell 在线发表题为pTα enhances mRNA translation and potentiates CAR T cells for solid tumor eradication 的研究论文,为了寻找增强CAR-T细胞功能持久性和效力的有效方法,该研究探索了将前T细胞特征整合到典型的基于CD28的CAR中的潜力。
胸腺细胞在β选择发育阶段发生增殖爆发,这是由前T细胞受体及其独特的pTα链驱动的。在多种液体和实体肿瘤模型中,携带pTα 1A结构域的CAR赋予T细胞更大的扩张、细胞因子的产生和体内持久性,同时降低耗竭和更大的长期肿瘤控制。结合1A结构域的CARs显示mRNA翻译主调控因子Y-Box结合蛋白1 (YBX1)的持续磷酸化,这是增强肿瘤根除所必需的。T细胞mRNA翻译的编程为调节和增强免疫治疗开辟了另一条途径。

靶向CD19的嵌合抗原受体(CAR)治疗的成功已经证明了T细胞工程的治疗潜力。CAR是一种合成受体,它引导T细胞识别选定的抗原并增强其功能特性。CAR-T细胞在难治性B细胞白血病和多发性骨髓瘤患者中引起了持久的反应。
两个CAR信号域占当前CAR-T细胞试验的准总数。它们都利用CD3-ζ链的细胞质域来启动T细胞激活,但它们的相关信号域不同,该信号域来自CD28或4-1BB。这两种信号结构对一系列白血病和淋巴瘤都有效,尽管在实体瘤患者中尚未产生一致、持久的反应。
这一结果表明需要进一步调整CAR设计用于实体肿瘤,这是通过将CAR结合和/或在CAR-T细胞中设计各种附加属性来增加其抗肿瘤活性和防止肿瘤逃逸的积极追求。
多种策略正在研究中,以多种抗原靶向,克服微环境障碍,或增加CAR-T细胞的效力和持久性。后者包括CAR信号强度的校准;转录因子的共表达或消融,如c-Jun过表达(OE)、BATF OE、FOXO1 OE、NR4A2敲除(KO)、TLE4 KO和IKZF2 KO;和表观遗传调整(SUV39H1 KO和DNMT3A KO)。
这些方法的一个共同目的是通过避免过早的T细胞耗竭来维持T细胞的功能,从而降低治疗效果。这些创新的临床验证仍在等待中。
该研究探索了前T细胞特性增强CAR -T细胞整体效力的潜力。胸腺αβ-T细胞发育产生大量的T细胞库,这些T细胞含有一种克隆型T细胞受体(TCR),这种T细胞受体仅限于自身MHC,并为自身抗原耐受而调节。在表达完整的TCR之前,新生T细胞表达一个pre-TCR,作为αβ谱系承诺的发育检查点。
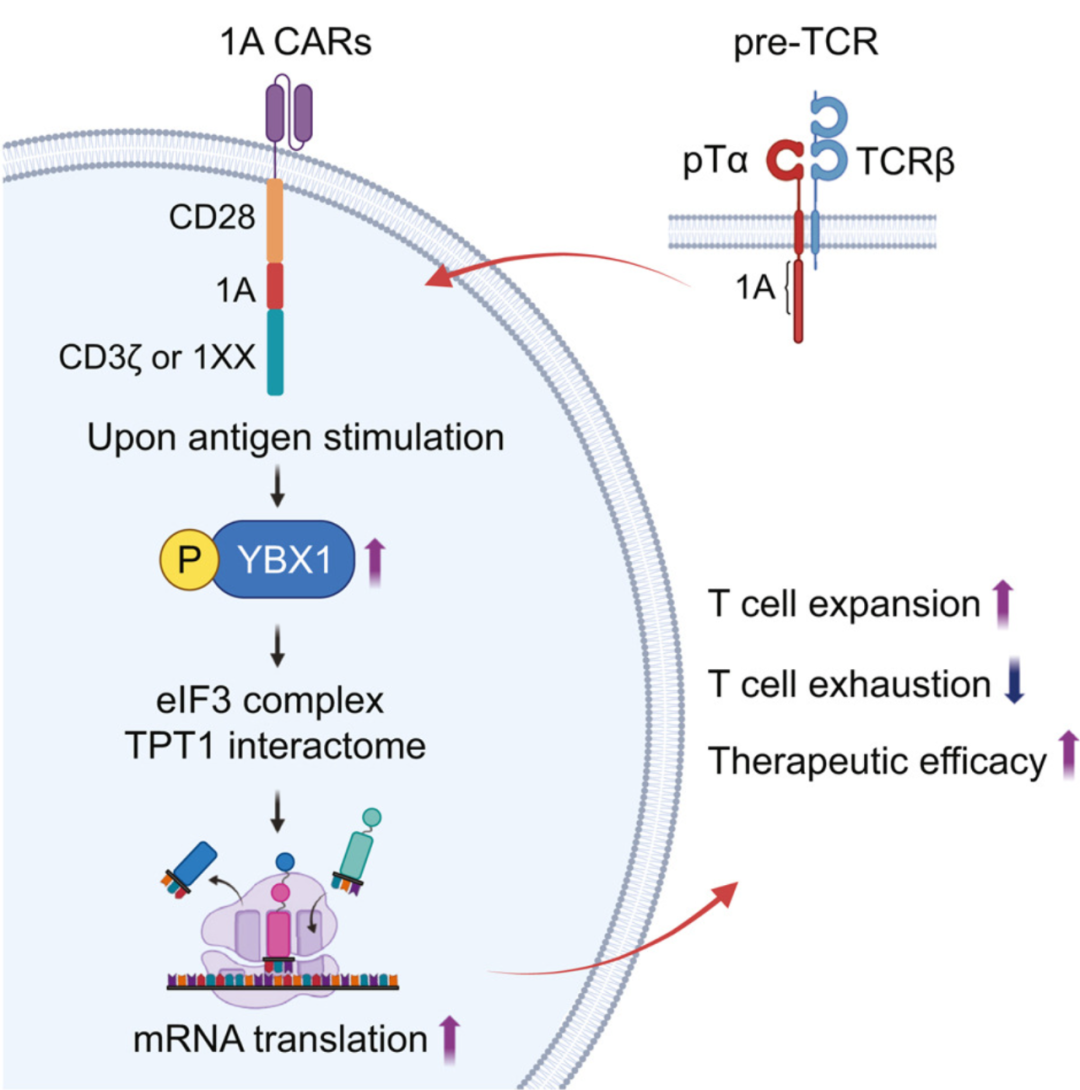
文章模式图(图源自Cell )
在CD4/CD8双阴性(DN)阶段,新出现的T细胞上调PTCRA表达,从而提供不变的pTα链与新重排的TCRβ链配对,并使细胞表面形成pre-TCR/CD3复合物。前TCR信号从DN晚期(DN3)到双阳性(DP)胚期发挥其活性,促进胸腺细胞分化,防止细胞死亡,并确保TCRβ等位基因的排除。在整个β选择检查点,胸腺细胞经历了一次主要的增殖爆发(占胸腺细胞的80%以上),从而为阳性选择提供了大量的候选细胞。
在这个发育阶段的细胞增殖估计会导致100-200倍的细胞扩增,支持产生多样化的预选TCR库。在TCRα链成功重排后,TCR取代了前TCR,不变的pTα的表达被消除。
TCR前信号传导使β选择的详细机制尚未完全阐明。大多数研究支持与配体无关的信号传导,基于匹配的前TCR链在细胞表面的配对,足以进行信号转导,而其他研究则认为前TCR与MHC相互作用的作用。无论哪种方式,pre-TCR复合物的信号功能仍有待揭示。
在成熟T细胞中,Pre-TCR在细胞表面的表达非常低,约比αβ-TCR低15-50倍。pTα包含114个氨基酸(aa)的胞内尾部,它驱动溶酶体和蛋白体中受体复合物的快速内化和降解,这表明需要一种机制来维持来自短暂受体的下游信号。
虽然pre-TCR参与诱导细胞内Ca2+升高和转录因子NFAT的激活,但研究人员注意到NFAT5缺陷胸腺细胞没有表现出增殖受损,这表明支持T细胞增殖的NFAT独立途径可能被pTα激活。
研究人员进一步假设,赋予CAR-T细胞pre-TCR样扩增特性会增加它们的抗肿瘤功效,但可能不会加速它们的功能耗竭,而功能耗竭通常是在持续的NFAT激活后发生的。
该研究证明利用T细胞前发育的独特特征提供了一种增强CAR-T细胞的替代机制,这依赖于Y-Box结合蛋白1 (YBX1)调节的mRNA翻译。
https://www.cell.com/cell/abstract/S0092-8674(25)01254-1
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


